|
| Einstein, altså! |
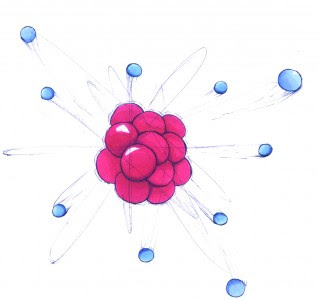
Fisjon er at en atomkjerne, feks uran-235, deler seg i to og blir til fisjonsprodukter, også blir det frigjort masse masse energi pluss noen ekstra nøytroner.
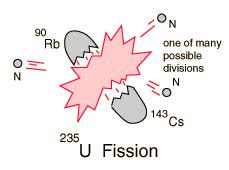 |
| Uran-235 deler seg i to, til cesium-143 og rubidium-90 - som er fisjonsprodukter. I tillegg blir det 3 løse/frie nøytroner og masse energi - den er selvsagt rooosa xD |
 |
| Einsteins berømte likning <3 |
Fisjon er faktisk Einstein sin super-famous likning - E=mc2 - i praksis, for energi (E) og masse (m) er bare to sider av samme sak.
Når en tung atomkjerne, som feks uran-235, eller uran-233 eller plutonium-239 fisjonerer så blir litt av massen (vekten) gjort om til energi! Så siden noe av massen er blitt til energi er det sånn at hvis du tar og putter de to fisjonsproduktene pluss de frie nøytronene på atomkjernevekten din og ser på hva vektnålen viser så er det mindre enn det atomkjernen opprinnelig veide...8-O Ennå du har akkurat like mange nøytroner og protoner hele tiden...halloo, liksom, du må jo bare eeelske <3 kjernefysikk <3 da xD
Nå tenker du kanskje at ok whatever, energi, liksom. Men det er faktisk syyykt mye energi som blir frigjort: faktisk 50 millioner ganger mer enn hvis du hadde en kjemisk reaksjon som når du brenner kull feks. Så hvis du har ca ett gram (!) med uran-235, også deler du alle disse atomkjernene i to, så får du nok energi til å dekke strømforbruket til en gjennosnittlig norsk familie i ETT ÅR! Hvis du skulle brenne kull istedetfor trenger du 4 tonn.
Jeg bare nevner det, liksom...